a LMWH hatása a véralvadásra
TARSZABÓ RÓBERT – SKRAPITS JUDIT – RUTTNER PÁL – HORVÁTH BOLDIZSÁR
VÁRANDÓS ANYÁK KÖRÉBEN
BEVEZETÉS
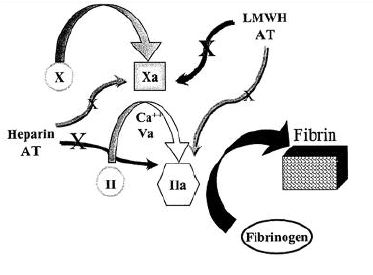
Az alacsony molekulatömegű heparin (LMWH) csoport minden tagjára jellemző, hogy elsősorban az aktivált X-es faktort (FXa) gátolják, kisebb mértékben az antithrombinra (AT) is hatnak, rövid életidejük miatt a laboratóriumi eredményekben megjelenő hatásukat csak 12–24 órán belüli variációk jellemzik (l. 1. ábra), (1–2).
Jóllehet a LMWH-kezelés során általában nincs szükség a hatóanyag hatásosságának ellenőrzésére, bizonyos esetekben (ha a kockázat nagy vagy igen nagy) hasznos az aktuális hatóanyagszint ismerete (1, 3–9). Ilyen helyzetek lehetnek a sürgősségi műtétek és beavatkozások előtt, vérzés jelentkezésekor, ha az öninjekciózó beteg a szert rendszertelenül vagy alkalmilag alul-, vagy túladagolja (időben/dózisban azaz rossz complience), a véralvadásgátlót szedő vesebeteg, vagy ha nagy a trombózis-kockázat (1, 10–18).
A szülészeti gyakorlatban a heparin megelőzés és főleg a kezelések során az ideális LMWH adagolásának megállapítására illetve a hatékonyság igazolására tehát csak extrém esetekben kerülhet sor. Ilyenek a kombinált és jelentős trombózishajlam esetei, ahol a megelőző, illetve kezelési dózis megválasztása fontos lehet, a testtömegnek az átlagost jelentősen meghaladó, vagy alulértékelt eseteiben. A betegekben az érvényes ajánlások nagy kockázat esetén napi kétszer 1–1,5 mg/tskg heparin adagját javasolják. De előfordulhat, hogy az ajánlott adag nem minden esetben megfelelő, illetve nincs az adott esetre ajánlás. Ekkor a kezelési dózis meghatározásában az Xf. aktivitás gálásának mérése és annak mértéke irányadást jelent a kezelőorvosnak (1, 4–6, 8–9).
ANYAG ÉS MÓDSZER
Trombózis megelőzése és kezelése során kezdetben nadroparint, később többnyire enoxaparint tartalmazó készítményeket alkalmaztunk a gyári előiratnak megfelelő adagolásban. Kórházunkban 2009-től lehetőségünk van az LMWH kezelés monitorizálására. Ha a heparin kezelése hatásosságának vizsgálati igénye felmerül, az Alvadási Laboratórium, a terhespatológiai és az angiológiai szakambulanciájával kollaborálva, a vizsgálati eredményt értékeli, és szükség esetén a kezelést közösen változtatják meg.

a LMWH hatása a véralvadásra
Az anti-Xa faktor aktivitás (heparin-szint) meghatározása a Siemens (Dade-Behring) Berichrom Heparin kit-jével történik, BCS XP analizátoron. A vizsgálat elve: A plazmában kötött állapotban található heparint felszabadították, többlépcsős folyamat után chromogén szubsztráttal reagáltatták, mely színreakcióhoz vezet. Spektrofotometriás mérés, majd kalibrációs görbe segítségével meghatározható a rendszerben jelen lévő heparin mennyisége (8, 12).
EREDMÉNYEK
2009 áprilisától 2014. augusztus 31-ig 46 várandós anyánál történt anti-Xa faktor aktvitás mértéke (Heparin szint) meghatározás, akik részben megelőzés, részben kezelés céljából kaptak heparint. Közülük 12 eset volt, ahol vagy az elhízás/kövérség, előzetes tromboembólia, vagy különböző, több esetben kombinált trombózishajlam állt fenn (l. táblázat). Őket a Bauersachs és mtsai. kockázatbecslője alapján és az Egészségügyi Minisztérium Szakmai irányelvét is követve a magas illetve igen magas kockázati csoportba soroltuk (1, 19).
A 12 beteg közül kiemelkedett az az anya, aki extrém módon elhízott volt (184 kg), és visszérgyulladásban is szenvedett. Esetünket már korábban közöltük (20).
A vizsgált 46 anya anti-Xf vizsgálati eredményéből 40 esetben a megválasztott heparin dózisa megfelelő volt. Ezek a betegek az alkalmazási előiratokban szereplő dózisban kapták a gyógyszert. Amennyiben a heparin szint az irodalomban javasolt 0,5–1,0 IU/ml alatti vagy feletti volt, a szer dózisának változtatására került sor. Hat esetben, továbbá a magas, illetve igen magas kockázati csoportból a heparin szint mérése alapján minden második esetben a dózist változtatni kellett, és ekkor már az ellenőrző vizsgálatok megfelelő értékűek voltak. A 12 magas, illetve igen magas kockázatú betegeink főbb klinikai és laboratóriumi eredményeit táblázatban foglaljuk össze (1. táblázat).
MEGBESZÉLÉS
Az Egészségügyi Minisztérium jelenleg érvényes szakmai irányelve alapján (a thromboemboliák kockázatának csökkentése és kezelése 2010) (1), ha LMWH sc. szert alkalmazunk alkalmazási előiratában foglalt terápiás adagban, nem szükséges az anti-FXa monitorizálása. azonban ha a beteg testsúlya meghaladja a 100 kg-ot, túlsúlyos (BMI>25), vagy elhízott (BMI >30), célszerű az anti-FXa meghatározásával – négy órával az injekció beadását követően – meggyőződni arról, hogy az előiratban szereplő adag elegendő-e, vagy pedig nagyobb/kisebb adagokra (gyakoribb, esetleg eltérő adagolásra) van szükség. Megfelelő heparin szint 0,5–1,0 NE/ml érték esetén áll fenn. Ugyancsak javasolt az anti-Xa-meghatározás végzése, ha az anya veseelégtelenségben (is) szenved (kreatrinion clearance < 30 ml/min), ilyenkor valószínű, hogy a készítmény előiratához képest kisebb dózis a megfelelő (1, 12–15, 22–23).
1. táblázat. A magas kockázatú 12 betegünk főbb klinikai és laboratóriumi adatai, kiemelve azokat, akikben a heparin adagját a méréseket követően változtattuk.
| Eset | Dg | BMI | Heparin szint* | Dózis (tól-ig) | Megjegyzés |
|---|---|---|---|---|---|
| G.O, 1984. | Thrombophlebitis profunda | 59,4 | 0,45-0,55 | 2x160, → 2x200 mg Clexane | sd.37,Metabolikus syndr.Ø SC Trombózis kezelés |
| P. P. 1978. | FVLeiden hz | 29,5 | 0,78-0,82 | 1x → majd 2x 0,4 ml Clexane | sd 29. SC abruptio placentae |
| H. K. 1986. | MVT + FVLeiden hs homozygota | 19,7 | 0,44-0,78 | 2x0,4, → majd 2x 0,6ml Clexane | sd 37. Warfarinról Clexanera, szöv.mentes |
| S. D. E. 1971. | SLE + APS | 22,15 | 0.41-0,59 | 2x 0,6 → majd 0,8 ml Fraxiparine +100 ACE | sd.37, SC szöv.mentes |
| G. Zs. 1972. | MTHFR + ACA | 28,6 | 0,54-1,08 | 1x0,4 → 1x 0,6 ml Clexa | s d.38. Szöv. mentes sp. szülés |
| E. I 1982. | MVT+PE + FVLeiden homozygota | 29 | 1,07 | 2x 0,6 ml Fraxiparine | sd.37. Szöv. mentes sp. szülés |
| L. K.E. 1981. | Synus cav. tromb. + ACA | 26,7 | 0,92 | 2x 0,6 ml Fraxiparine | sd.38. SC szöv.mentes |
| H. K. A. 1976. | Varicositas cruris et pelv.min.+ Trigemini | 28,5 | 0,40-0,66 | 2x 0,6 → majd 0,8 ml Clexane | sd.34. Trigemini, IVF CS |
| M. P. R. 1977. | Előzményben MVT | 31,6 | 0,65 | 2x 0,6 ml Clexane | sd.37. SC szöv.mentes |
| V.E.I. 1979. | FV Leiden homozygota | 24,6 | 1,08-0,88 | 2x 1,0 → majd 2x0,8 ml Clexane | sd.37. SC szöv.mentes |
| F.V. 1979. | G20210A. + MVT+PE | 27,8 | 0,69-0,87 | 2x 0,6 ml Clexane | sd.38. SC szöv.mentes |
| B.R | Sinus cavernosis thrombosis | 31 | 0,53-1.25 | 2x 0,8 → majd 1,0 ml. Clexane | sd.38. SC. szöv.mentes |
* aXf aktivitása szint mérése a heparin beadását követő 4. órában; rövidítések: APS: antifoszfolipid szindróma; ASA: anti-cardiolipin antitest szindróma; BMI: testtömeg index; G20210A: Protrombin gén mutáció; MTHFR: Methylentetrahydrofolat reductas enzimdefektus; MVT, PE: mélyvénás trombózis és pulmonális embólia; SC: császármetszés, SLE szisztémás lupus erythrematosus; SD: terhességi hét a szülés idején.
Az anti Xf. aktivitás vizsgálatával megerősíthető, hogy közepes kockázatban elegendő az alkalmazási előírásban szereplő dózis. Magas vagy igen magas kockázat esetén, pláne ha a beteg súlya 100 kg felett van, célszerű a kezelés hatékonyságáról a heparin szint meghatározásával meggyőződni.
Ismereteink szerint heparin-szint meghatározás hazánkban egyelőre kevés ellátó helyen áll rendelkezésre, pedig vannak esetek – mint látjuk –, mikor a helyes dózis megválasztása és visszaigazolása a klinikus számára fontos lehet. A fenti vizsgálatokról illetve eredményekről várandós anyákban irodalmi adatokat nem találtunk, ezért láttuk érdemesnek tapasztalatainkat közölni.
IRODALOM
Az Egészségügyi Minisztérium Szakmai Irányelve: A Thromboemboliák Kockázatának Csökkentése
és Kezelése. szerk. Pfliegler györgy 2010.
BODA Z., LÁSZLÓ P., PFLIEGLER G., TORNAI I., REJTŐ L. és SCLAMMADINGER Ágota:
Thrombophilia, anticoaguláns terápia és terhesség. Orvosi Hetilap, 1998; 139 (52): 3113–3116. old.
HORVÁTH B, PFLIEGLER Gy: Tehetünk-e többet a thromboemboliák és a következményes anyai
halálozás csökkentésében a szülészetben? Magyar Nőorvosok Lapja, 2012; 75. (1): 4–13. old.
FRANCHINI M.: Haemostasis and pregnancy. Thromb Haemost 2006; 95: 401–413. KUPFERNIC
M.: Thrombophilia and pregnancy Reprod Biol Endocrin 2003; 1: 1–22.
FRIEDRICH A, HAMEED A. B.: Fluctuations in anti-factor Xa levels with therapeutic enoxaparin
anticoagulation in pregnancy Journal of Perinatology 2010; 30 (3): 253–257.
Christopher M. LEHMAN, MD, Elizabeth L. FRANK: Laboratory Monitoring of Heparin Therapy:
Partial Thromboplastin Time or anti-Xa Assay? Labmedicine 2009;.40 (1): 47–51.
PABINGER I., GREINACHER A.: Anti-factor xa plasma levels in pregnant women receiving low
molecular weight heparin thromboprophylaxis. Obstet Gynecol. 2009; 113 (3): 740–741.
FOX NS, LAUGHON SK, BENDER SD, SALTZMAN DH, REBARBER A.: Anti-factor Xa plasma
levels in pregnant
women receiving low molecular weight heparin for thromboprophylaxis.
Obstet Gynecol. 2008; 112 (4): 884–9.
ROJAS L., AIZMAN A., ERNST D, ACUÑA M P., MOYA P., MELLADO R., CERDA J.: Anti-Xa Activity After Enoxaparin Prophylaxis In
Hospitalized Patients Weighing Less Than Fifty-Five kilograms Thromb res. 2013; 132 (6): 761–764.
BERGES A., LAPORTE S., EPINAT M., ZUFFEREY P., ALAMARTINE E., TRANCHAND B.,
DECOUSUS H.,
MISMETTI P.; PROPHRE.75 Study Group: Anti-factor Xa activity of enoxaparin administered at prophylactic dosage
to patients over 75 years old. Br J Clin Pharmacol.
2007; 64 (4): 428–438.
SUZUKI A., KANEKO M., KANNO N., YATOMI Y.: Assessment of anti-factor Xa activity for
heparin and related products by chromogenic assays and thrombin generation tests. Rinsho
Byori. 2013; 61 (7): 567–75.
BARUCH L.: Laboratory monitoring of anticoagulant medications: focus on novel oral anticoagulants.
Postgrad Med. 2013; 125 (2): 135–45.
GOUYA G., PALKOVITS S., KAPIOTIS S., MADL C., LOCKER G., STELLA A., WOLZT M.,
HEINZ G.:
Bioactivity of enoxaparin in critically ill patients with normal renal function. Br J
Clin Pharmacol. 2012; 74 (5): 806–814.
ROMMERS MK., VAN DER LELY NN, EGBERTS TC., VAN DEN BEMT PM.: Anti-Xa activity
after subcutaneous administration
of dalteparin in ICU patients with and without subcutaneous
oedema: a pilot study. Crit Care. 2006; 10 (3): 93–94.